В ранните часове на 29 декември NEJM публикува онлайн ново клинично проучване от фаза III на новия китайски коронавирус VV116. Резултатите показват, че VV116 не е по-лош от Paxlovid (нематовир/ритонавир) по отношение на продължителността на клиничното възстановяване и има по-малко нежелани реакции.
Източник на изображението: NEJM
Медиана на времето за възстановяване 4 дни, честота на нежелани събития 67,4%
VV116 е перорално нуклеозидно лекарство срещу новия коронавирус (SARS-CoV-2), разработено в сътрудничество с Junsit и Wang Shan Wang Shui, и е RdRp инхибитор заедно с ремдесивир на Gilead, молнупиравир на Merck Sharp & Dohme и азелвудин на Real Biologics.
През 2021 г. в Узбекистан беше завършено клинично изпитване фаза II на VV116. Резултатите от проучването показаха, че групата, приемаща VV116, може по-добре да подобри клиничните симптоми и значително да намали риска от прогресия до критична форма и смърт в сравнение с контролната група. Въз основа на положителните резултати от това изпитване, VV116 беше одобрен в Узбекистан за лечение на пациенти с умерен до тежък COVID-19 и се превърна в първото ново перорално лекарство за коронарни заболявания, одобрено за пускане на пазара в чужбина в Китай [1].
Това клинично изпитване фаза III[2] (NCT05341609), ръководено от проф. Джао Рен от болница „Шанхай Руйджин“, проф. Гаоюан от болница „Шанхай Ренджи“ и академик Нинг Гуанг от болница „Шанхай Руйджин“, е проведено по време на епидемията, причинена от варианта на Omicron (B.1.1.529), от март до май в Шанхай, с цел да се оцени ефикасността и безопасността на VV116 спрямо Paxlovid за ранно лечение на пациенти с лека до умерена форма на COVID-19. Целта беше да се оцени ефикасността и безопасността на VV116 спрямо Paxlovid за ранно лечение на пациенти с лека до умерена форма на COVID-19.
Източник на изображението: Референция 2
Многоцентрово, заслепено от наблюдателя, рандомизирано, контролирано проучване с 822 възрастни пациенти с Covid-19 с висок риск от прогресия и с леки до умерени симптоми е проведено между 4 април и 2 май 2022 г., за да се оцени допустимостта на участниците от седем болници в Шанхай, Китай. В крайна сметка 771 участници са получили или VV116 (384, 600 mg на всеки 12 часа на ден 1 и 300 mg на всеки 12 часа на ден 2-5), или Paxovid (387, 300 mg ниматувир + 100 mg ритонавир на всеки 12 часа в продължение на 5 дни) като перорално лекарство.
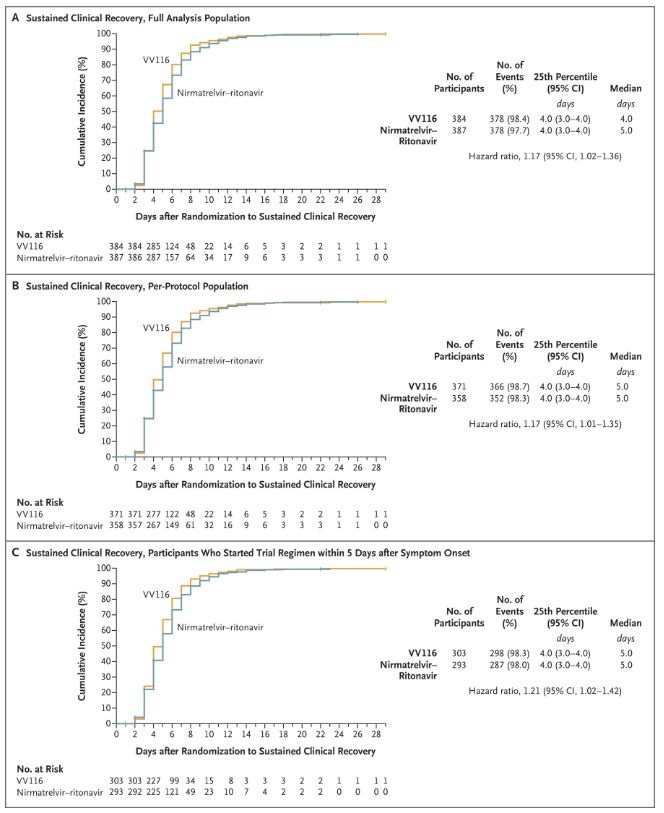
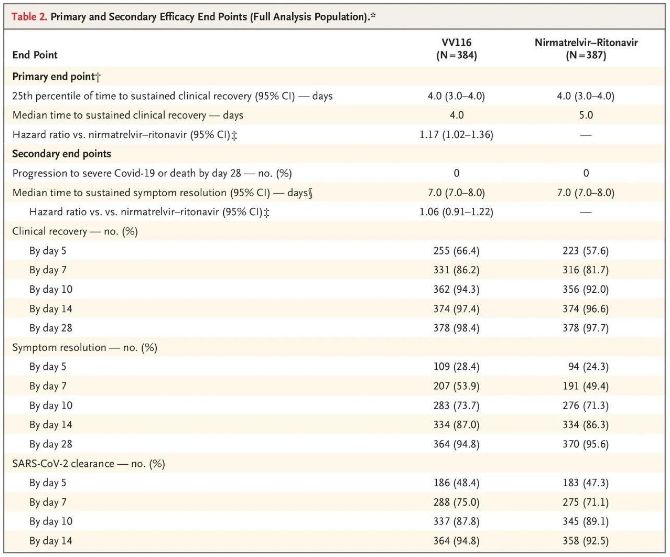
Резултатите от това клинично проучване показват, че ранното лечение с VV116 за лек до умерен COVID-19 е постигнало първичната крайна точка (време до устойчиво клинично възстановяване), предвидена от клиничния протокол: средното време до клинично възстановяване е било 4 дни в групата на VV116 и 5 дни в групата на Paxlovid (коефициент на риск 1,17; 95% CI 1,02 до 1,36; долна граница >0,8).
Поддържане на времето за клинично възстановяване
Първични и вторични крайни точки за ефикасност (цялостен анализ на популацията)
Източник на изображението: Референция 2
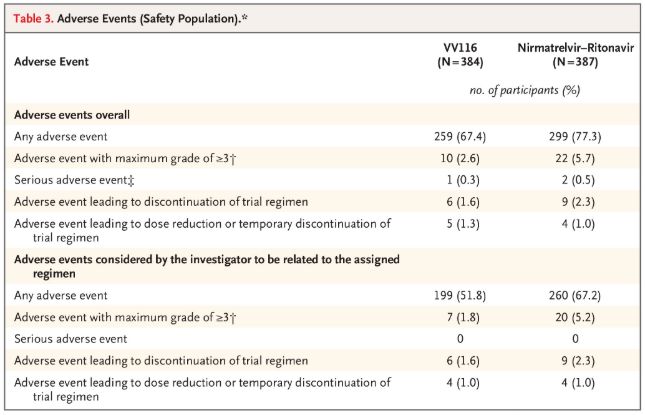
По отношение на безопасността, участниците, получаващи VV116, съобщават за по-малко нежелани реакции (67,4%) в сравнение с тези, получаващи Paxlovid (77,3%) при 28-дневното проследяване, а честотата на нежелани реакции от степен 3/4 е по-ниска за VV116 (2,6%), отколкото за Paxlovid (5,7%).
Нежелани събития (безопасни хора)
Източник на изображението: Референция 2
Спорове и въпроси
На 23 май 2022 г. Juniper разкри, че клиничното проучване фаза III за регистрация на VV116 спрямо PAXLOVID за ранно лечение на лек до умерен COVID-19 (NCT05341609) е достигнало основната си крайна точка.
Източник на изображението: Референция 1
Във време, когато липсваха подробности за изпитването, противоречията около проучването Фаза III бяха двойни: първо, то беше едносляпо проучване и при липсата на плацебо контрола се опасяваха, че ще бъде трудно да се прецени лекарството напълно обективно; второ, имаше въпроси относно клиничните крайни точки.
Клиничните критерии за включване за Juniper са (i) положителни резултати от новия тест за корона, (ii) един или повече леки или умерени симптоми на COVID-19 и (iii) пациенти с висок риск от тежко протичане на COVID-19, включително смърт. Единствената първична клинична крайна точка обаче е „времето до устойчиво клинично възстановяване“.
Точно преди обявяването, на 14 май, Juniper преразгледа клиничните крайни точки, като премахна една от първичните клинични крайни точки, „пропорция на преминаване към сериозно заболяване или смърт“ [3].
Източник на изображението: Референция 1
Тези два основни спорни въпроса също бяха специално разгледани в публикуваното проучване.
Поради внезапното разпространение на Omicron, производството на плацебо таблетки за Paxlovid не беше завършено преди началото на изпитването и следователно изследователите не успяха да проведат това изпитване, използвайки двойно-сляп, двойно-моделен дизайн. Що се отнася до единично-сляпия аспект на клиничното изпитване, Juniper заяви, че протоколът е проведен след комуникация с регулаторните органи и че единично-сляпият дизайн означава, че нито изследователят (включително оценителя на крайната точка на изследването), нито спонсорът ще знаят специфичното терапевтично разпределение на лекарството, докато окончателната база данни не бъде заключена в края на проучването.
До момента на окончателния анализ, никой от участниците в проучването не е имал смъртен случай или прогресия до тежко Covid-19 събитие, така че не могат да се направят заключения относно ефикасността на VV116 за предотвратяване на прогресията до тежко или критично Covid-19 или смърт. Данните показват, че очакваното средно време от рандомизацията до устойчива регресия на свързаните с Covid-19 целеви симптоми е 7 дни (95% CI, 7 до 8) и в двете групи (коефициент на риск, 1,06; 95% CI, 0,91 до 1,22) [2]. Не е трудно да се обясни защо първичната крайна точка „процент на преминаване към тежко заболяване или смърт“, която първоначално е била определена преди края на проучването, е била премахната.
На 18 май 2022 г. списанието Emerging Microbes & Infections публикува резултатите от първото клинично изпитване на VV116 при пациенти, заразени с варианта на Omicron [4], отворено, проспективно кохортно проучване със 136 потвърдени хоспитализирани пациенти.
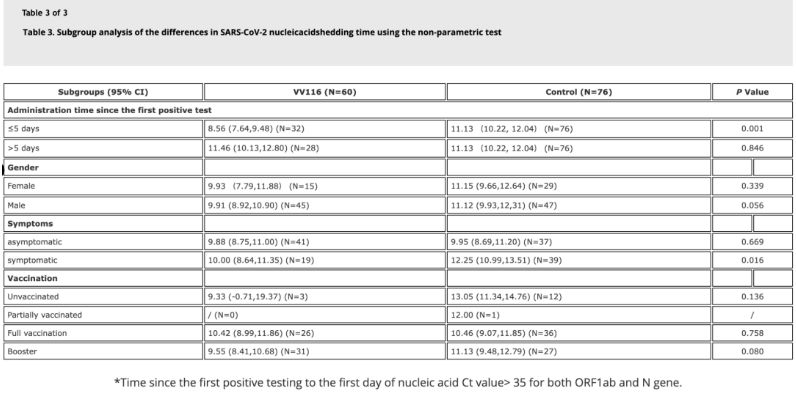
Данните от проучването показват, че пациенти с Omicron инфекция, които са използвали VV116 в рамките на 5 дни след първия си положителен тест за нуклеинова киселина, са имали време до регресия на нуклеиновата киселина от 8,56 дни, по-малко от 11,13 дни в контролната група. Приложението на VV116 на симптоматични пациенти в рамките на времевата рамка на това проучване (2-10 дни след първия положителен тест за нуклеинова киселина) е намалило времето до регресия на нуклеиновата киселина при всички пациенти. По отношение на безопасността на лекарството, не са наблюдавани сериозни нежелани реакции в групата на лечение с VV116.
Източник на изображението: Референция 4
В момента текат три клинични проучвания на VV116, две от които са проучвания фаза III при лек до умерен COVID-19 (NCT05242042, NCT05582629). Другото проучване за умерен до тежък COVID-19 е международно многоцентрово, рандомизирано, двойносляпо клинично проучване фаза III (NCT05279235) за оценка на ефикасността и безопасността на VV116 в сравнение със стандартното лечение. Според съобщението на Juniper, първият пациент е бил включен и е получил доза през март 2022 г.
Източник на изображението: clinicaltrials.gov
Референции:
[1]Junshi Biotech: Съобщение относно основната крайна точка на регистрираното клинично проучване фаза III на VV116 спрямо PAXLOVID за ранно лечение на лек до умерен COVID-19
[2]https://www.nejm.org/doi/full/10.1056/NEJMoa2208822?query=featured_home[3]https://clinicaltrials.gov/ct2/show/record/NCT05341609[4] Ensi Ma, Jingwen Ai, Yi Zhang, Jianming Zheng, Xiaogang Gao, Junming Xu, Hao Yin, Zhiren Fu, Hao Xing, Li Li, Liying Sun, Heyu Huang, Quanbao Zhang, Linlin Xu, Yanting Jin, Rui Chen, Guoyue Lv, Zhijun Zhu, Wenhong Zhang, Zhengxin Wang. (2022) Профил на инфекции с Omicron и статус на ваксинация сред 1881 реципиенти на чернодробна трансплантация: многоцентрова ретроспективна кохорта. Нововъзникващи микроби и инфекции 11:1, страници 2636-2644.
Време на публикуване: 06 януари 2023 г.
 中文网站
中文网站